Wolfram(IV)-oxid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
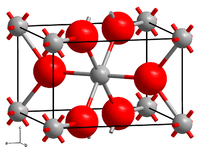
| |||||||||||||||||||
| _ W4+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Wolfram(IV)-oxid | ||||||||||||||||||
| Andere Namen |
Wolframdioxid | ||||||||||||||||||
| Verhältnisformel | WO2 | ||||||||||||||||||
| Kurzbeschreibung |
braun oder bronzefarben[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 215,84 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
10,72 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt |
1500 – 1600 °C[2] | ||||||||||||||||||
| Siedepunkt |
1730 °C[2] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Wolfram(IV)-oxid ist eine chemische Verbindung aus der Gruppe der Metalloxide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Wolfram(IV)-oxid kann durch Reduktion von Wolfram(VI)-oxid mit Wolfram oder Wasserstoff[1] bzw. durch Reaktion von Wolfram mit Wasserdampf jeweils bei hohen Temperaturen gewonnen werden.
Einkristalle des Oxides lassen sich durch eine CVT-Methode (Chemical Vapor Transport) herstellen. Hierfür wird zunächst Wolfram(VI)-oxid mit elementarem Wolfram unter Zugabe einiger mg Iod in einer abgeschmolzenen und evakuierten Ampulle bei 1100 °C zum polykristallinen Oxid umgesetzt. Das gold-braune Oxid wird dann mit etwa 1 % Iod in eine neue Ampulle eingeschmolzen und diese in einen 2-Zonen-Ofen eingebracht, sodass je die Hälfte der Ampulle in einer der Zonen liegt. Während die eine Hälfte der Ampulle auf 1000 °C aufgeheizt wird, wird die andere bei 960 °C gehalten. Nach 3 Tagen Reaktionszeit (bei anfänglich eingesetzten 0,5 g Oxid) lässt man die Ampulle abkühlen und erhält nach dem Öffnen etwa 2 mm große goldene Einkristalle der Zielverbindung.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Wolfram(IV)-oxid ist je nach Verteilungsgrad eine braune (Pulver) bis bronzefarbene (Einkristalle)[1] diamagnetische und metallisch leitende Verbindung. Sie besitzt eine monokline Kristallstruktur ähnlich der von Rutil.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Wolframoxide wie Wolfram(IV)-oxid sind Bestandteil von Katalysatoren für die Petrochemie und für die selektive katalytische Reduktion von Stickoxiden mit NH3 in Verbrennungsabgasen von Kraftwerken. Sie werden weiterhin in Gläsern, Glasuren und Keramiken eingesetzt.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Patentanmeldung DE102007011865A1: Verfahren zur Herstellung von Wolframoxidschichten und Verwendung. Angemeldet am 8. März 2007, veröffentlicht am 18. September 2008, Anmelder: Verein zur Förderung von Innovationen durch Forschung, Entwicklung und Technologietransfer e.V., Erfinder: Andreas Amrell et al.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1564.
- ↑ a b c d e f Eintrag zu Wolfram(IV)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 16. Februar 2017. (JavaScript erforderlich)
- ↑ D. B. Rogers et al.: Single crystals of transition-metal dioxides - C. Tungsten dioxide and β-rhenium dioxide. In: F. A. Cotton (Hrsg.): Inorganic Syntheses. Band 13. McGraw-Hill Book Company, Inc., 1972, ISBN 07-013208-9 (defekt), S. 135–145 (englisch).
- ↑ Wells, A.F. (1984), Structural Inorganic Chemistry (5th ed.), Oxford: Clarendon Press, ISBN 0-19-855370-6

