Nukleoside

Nukleoside (auch Nucleoside) sind organische Moleküle, die aus einer Nukleobase und einer Pentose bestehen. In einer Zelle kommen verschiedene Nukleoside vor, die sich im Basen- oder Zuckeranteil unterscheiden. Sie enthalten im Unterschied zu den Nukleotiden von Nukleinsäuren (DNA oder RNA) keine Phosphatreste.
Grundtypen
[Bearbeiten | Quelltext bearbeiten]Die fünf Grundtypen der Nukleoside bestehen entweder aus einer Purin- oder einer Pyrimidinbase. Wenn sie Bausteine einer RNA sind, ist die Pentose (ein Einfachzucker mit fünf C-Atomen) die Ribose, in der DNA liegt als Pentose die Desoxyribose vor. Deshalb nennt man die Bausteine der DNA genauer Desoxynukleoside, während Nukleoside im engeren Sinne die Bausteine der verschiedenen RNA-Formen sind. Die Verknüpfung von Base und Pentose erfolgt bei den Purin-Basen stets über das Stickstoffatom in Position 9, bei den Pyrimidin-Basen über das Stickstoffatom in Position 1 und das C1′-Atom des Zuckers.
Purin-Basen
[Bearbeiten | Quelltext bearbeiten]| Nukleobase | Nukleosid | Desoxynukleosid |
|---|---|---|

|

|
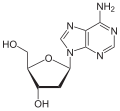
|
| Adenin | Adenosin, A | Desoxyadenosin, dA |

|
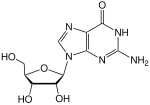
|

|
| Guanin | Guanosin, G | Desoxyguanosin, dG |
Anmerkung: Es ist jeweils nur eine der möglichen tautomeren Strukturen dargestellt.
Pyrimidin-Basen
[Bearbeiten | Quelltext bearbeiten]| Nukleobase | Nukleosid | Desoxynukleosid |
|---|---|---|
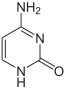
|

|

|
| Cytosin | Cytidin, C | Desoxycytidin, dC |
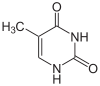
|

|

|
| Thymin | Ribothymidin T[1] (= 5-Methyluridin) | Desoxythymidin, dT |

|
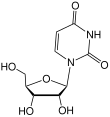
|

|
| Uracil | Uridin, U | Desoxyuridin, dU |
Abwandlungen der Grundformen
[Bearbeiten | Quelltext bearbeiten]Neben diesen Grundformen gibt es noch zahlreiche Modifikationen, die vor allem in den tRNAs und rRNAs zu finden sind.[2] Einige finden sich auch in der DNA.[3] Diese veränderten Nukleoside entstehen in der Regel erst nach der Transkription und dienen einer Feineinstellung von Struktur, Aktivität und Spezifität der Moleküle. Die meisten Modifikationen entstehen durch Methylierung.
Einen Überblick über die möglichen Abwandlungen soll die folgende Auswahl geben. Zum Vergleich sind die Grundformen ebenfalls angeführt:
Pyrimidin-Nukleoside
[Bearbeiten | Quelltext bearbeiten]| Name | Symbol | Pyrimidin-Grundstruktur | R1 | R2 | R3 | R4 | R5 | R6 |
|---|---|---|---|---|---|---|---|---|
| Cytidin | C |  |
Ribose | =O | –NH2 | |||
| 3-Methylcytidin | m3C | Ribose | =O | –CH3 | –NH2 | |||
| 5-Methylcytidin | m5C | Ribose / Desoxyribose | =O | –NH2 | –CH3 | |||
| N4-Methylcytidin | m4C | Ribose / Desoxyribose | =O | –NH–CH3 | ||||
| N4,N4-Dimethylcytidin | m42C | Ribose | =O | –N(CH3)2 | ||||
| 2′-O-Methylcytidin | Cm | 2′-O-Methyl-ribose | =O | –NH2 | ||||
| Isocytidin (synth.) | iC | Ribose | –NH2 | =O | ||||
| Pseudocytidin (synth.) | ΨC | –H | =O | –NH2 | Ribose | |||
| Pseudoisocytidin (synth.) | psiC | –H | –NH2 | =O | Ribose | |||
| 2-Thiocytidin | s2C | Ribose | =S | –NH2 | ||||
| N4-Acetylcytidin | ac4C | Ribose | =O | –NH–CO–CH3 | ||||
| Uridin | U | Ribose | =O | =O | ||||
| 3-Methyluridin | m3U | Ribose | =O | –CH3 | =O | |||
| 2′-O-Methyluridin | Um | 2′-O-Methyl-ribose | =O | =O | ||||
| Pseudouridin | P, Ψ, Ψrd | –H | =O | =O | Ribose | |||
| Dihydrouridin | D, UH2, Uh | Ribose | =O | =O | –H,–H | –H,–H | ||
| 5-Methoxyuridin | mo5U | Ribose | =O | =O | –O–CH3 | |||
| 5-(Carboxyhydroxymethyl)-Uridin | chm5U | Ribose | =O | =O | –CH(OH)–CO2CH3 | |||
| 5-Carboxymethylaminomethyl-Uridin | cmnm5U | Ribose | =O | =O | –CH2–NH–CH2–CO2CH3 | |||
| 5-Methylaminomethyl-Uridin | mnm5U | Ribose | =O | =O | –CH2–NH–CH3 | |||
| 5-Methoxy-carbonylmethyl-Uridin | mcm5U | Ribose | =O | =O | –CH2–CO2CH3 | |||
| 2-Thiouridin | s2U | Ribose | =S | =O | ||||
| 4-Thiouridin | s4U | Ribose | =O | =S | ||||
| Ribothymidin (= 5-Methyluridin) | T, m5U | Ribose | =O | =O | –CH3 | |||
| Dihydrothymidin | Desoxyribose | =O | =O | –H,–CH3 | –H,–H |
Purin-Nukleoside
[Bearbeiten | Quelltext bearbeiten]| Name | Symbol | Purin-Grundstruktur | R1 | R2 | R3 | R4 | R5 | R6 | R7 | R8 | R9 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Adenosin | A |  |
–NH2 | Ribose | |||||||
| 1-Methyladenosin | m1A | –CH3 | –NH2 | Ribose | |||||||
| 2-Methyladenosin | m2A | –CH3 | –NH2 | Ribose | |||||||
| N6-Methyladenosin | m6A | –NH–CH3 | Ribose / Desoxyribose | ||||||||
| N6,N6-Dimethyladenosin | m62A | –N(CH3)2 | Ribose | ||||||||
| 2′-O-Methyladenosin | Am | –NH2 | 2′-O-Methyl-ribose | ||||||||
| Inosin | I | =O | Ribose | ||||||||
| 1-Methylinosin | m1I | –CH3 | =O | Ribose | |||||||
| 2′-O-Methylinosin | Im | =O | 2′-O-Methyl-ribose | ||||||||
| Guanosin | G | –NH2 | =O | Ribose | |||||||
| 1-Methylguanosin | m1G | –CH3 | –NH2 | =O | Ribose | ||||||
| 7+-Methylguanosin | m7G | –NH2 | =O | –CH3 | Ribose | ||||||
| N2-Methylguanosin | m2G | –NH–CH3 | =O | Ribose | |||||||
| N2,N2-Dimethylguanosin | m22G | –N(CH3)2 | =O | Ribose | |||||||
| 2′-O-Methylguanosin | Gm | –NH2 | =O | 2′-O-Methyl-ribose | |||||||
| Isoguanosin (synth.) | iG | =O | –NH2 | Ribose |
Hypermodifizierte Nukleoside und mit verändertem Basengrundgerüst
[Bearbeiten | Quelltext bearbeiten]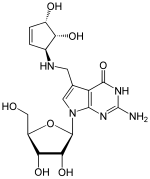
|
|
| Queuosin (Q, obiges Bild) β-D-Galactosyl-queuosin (galQ) β-D-Mannosyl-queuosin (manQ) |
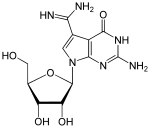
Archaeosin (G*, kommt nur in Archaeen vor) |
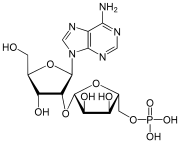
|

|
| 2′-O-Ribosyladenosinphosphat (Ar(p), rAMP) nur in Eukaryoten gefunden |
Wybutosin (Y, yW; obiges Bild) Wyosin (Wyo, imG) |

|

|
| N6-Threonylcarbamoyladenosin (t6A) | Lysidin (k2C) |
Variationen der Pentosen
[Bearbeiten | Quelltext bearbeiten]| Nukleobase | (Ribosyl)Nukleosid | Desoxynukleosid | Arabinosylnukleosid | (Methylribosyl)Nukleosid |
|---|---|---|---|---|

|
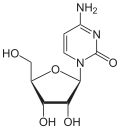
|

|
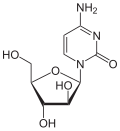
|

|
| Cytosin | Cytidin, C | Desoxycytidin, dC | Cytarabin, araC | 2′-O-Methylcytidin, Cm |
Physiologie
[Bearbeiten | Quelltext bearbeiten]Wird die Hydroxygruppe des C-5-Atoms der Pentose eines Nukleosids mit Phosphat verestert, entsteht das entsprechende Nukleotid. Je nach Anzahl der Phosphat-Reste spricht man von Mono-, Di- und Triphosphaten. Aus der zentralen Bedeutung der Nukleotide ergibt sich die gleiche Bedeutung für die entsprechenden Nukleoside, da sie als Baustein der Nukleotide in diese umgewandelt werden können.
Die Nukleoside stehen durch Abspaltung der letzten Phosphatgruppe in den Nukleotiden mittels Hydrolyse, mithilfe von Nukleotidase-Enzymen in allen Lebewesen zur Verfügung. Weiterhin kann Inosin aus Adenosin mittels der AMP-Desaminase oder der Guanin-Desaminase synthetisiert werden. Xanthosin ist entsprechend nicht nur durch Hydrolyse von XMP erhältlich, sondern auch aus Guanosin mittels der Guanosin-Desaminase.
Der Abbau erfolgt über Nukleosidasen zur Nukleobase und bei Purinen über Xanthin zur Harnsäure bzw. bei Pyrimidinen zum Alanin oder zur 2-Aminobuttersäure.
Nukleosid-Analoga
[Bearbeiten | Quelltext bearbeiten]Nukleosid-Analoga spielen vor allem in der antiretroviralen Therapie eine große Rolle. Eine Reihe moderner Virostatika enthalten diese Substanzen. Wohl am besten bekannt ist der Wirkstoff Aciclovir, der häufig gegen Herpes-simplex-Viren (HSV-1 und -2) eingesetzt wird. Weiterhin verbreitet ist Ganciclovir, das genau wie Aciclovir ein Guanosin-Analogon ist, und spezifisch die Replikation von CMV unterdrückt. Ein weiteres wichtiges Einsatzgebiet ist die Krebstherapie. So werden 5-Fluorouracil und Cytarabin als Zytostatika eingesetzt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Löffler, Petrides, Heinrich: Biochemie und Pathobiochemie. 8. Auflage. Springer, Heidelberg 2007, ISBN 978-3-540-32680-9.
- ↑ Patrick A. Limbach, Pamela F. Crain, James A. McCloskey: „Summary: the modified nucleosides of RNA“, Nucleic Acids Research, 1994, 22 (12), S. 2183–2196 (doi:10.1093/nar/22.12.2183, PMC 523672 (freier Volltext), PMID 7518580).
- ↑ Melanie Ehrlich, Miguel A. Gama-Sosa, Laura H. Carreira, Lars G. Ljungdahl, Kenneth C. Kuo, Charles W. Gehrke: „DNA methylation in thermophilic bacteria: N4-methylcytosine, 5-methylcytosine, and N6-methyladenine“, Nucleic Acids Research, 1985, 13 (4), S. 1399–1412 (doi:10.1093/nar/13.4.1399, PMC 341080 (freier Volltext), PMID 4000939).