Dimethyltellurid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
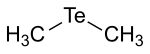
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethyltellurid | ||||||||||||||||||
| Summenformel | C2H6Te | ||||||||||||||||||
| Kurzbeschreibung |
gelbliche Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 157,67 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Ethanol[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Dimethyltellurid mit der Konstitutionsformel Te(CH3)2 ist eine chemische Verbindung aus der Gruppe der Organotellurverbindungen.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Dimethyltellurid wird in Organismen, speziell Mikroorganismen (z. B. den Pilzen Penicillium brevicaule, P. chrysogenum und P. notatum sowie im Bakterium Pseudomonas fluorescens[3]), aber auch in Tieren und Menschen, aus anorganischen Tellurverbindungen gebildet. Menschen geben die knoblauchartig riechende Verbindung nach Exposition mit Tellur oder Tellurverbindungen eventuell monatelang über die Atemluft, Schweiß, Harn oder die Haut ab.[4][5] Die Bildung von Dimethyltellurid auf diesem Weg wurde 1939 entdeckt.[6]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Dimethyltellurid kann durch Reaktion von Natriumtellurid oder Kaliumtellurid mit Methyliodid gewonnen werden.[4]
Ebenfalls möglich ist die Reaktion von Trimethyltelluriodid mit Triphenylphosphan oder Tributylphosphan.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Dimethyltellurid ist eine gelbliche Flüssigkeit mit knoblauchartigem Geruch, die löslich in Ethanol ist.[1] An Luft wandelt sie sich direkt zu Dimethyltelluroxid um.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Dimethyltellurid wird als Standard für die Gaschromatographie verwendet.[4]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Dimethyltellurid ist giftig und schädigt Leber, Herz, Nieren und Blut.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 222 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Rukma S. T. Basnayake, Janet H. Bius, Osman M. Akpolat, Thomas G. Chasteen: Production of dimethyl telluride and elemental tellurium by bacteria amended with tellurite or tellurate. In: Applied Organometallic Chemistry. 15, 2001, S. 499, doi:10.1002/aoc.186.
- ↑ a b c d Wolfgang A. Herrmann, Christian Erich Zybill: Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 4, 1997 Volume 4: Sulfur, Selenium and Tellurium. Georg Thieme Verlag, 2014, ISBN 3-13-179191-8, S. 215 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft Vorkommen, Eigenschaften und Anwendung von Riechstoffen und deren Gemischen. Springer-Verlag, 2015, ISBN 978-3-658-07310-7, S. 90 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Marjorie L. Bird, Frederick Challenger: 39. The formation of organo-metalloidal and similar compounds by micro-organisms. Part VII. Dimethyl telluride. In: Journal of the Chemical Society (Resumed). 1939, S. 163, doi:10.1039/JR9390000163.
- ↑ Adolph Strecker: Adolph Strecker's K Kurzes lehrbuch der organischen chemie. 1874, S. 278 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ W. Ternes: Biochemie der Elemente Anorganische Chemie biologischer Prozesse. Springer-Verlag, 2012, ISBN 978-3-8274-3020-5, S. 366 (eingeschränkte Vorschau in der Google-Buchsuche).

