2-Aminopyrimidin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Aminopyrimidin | ||||||||||||||||||
| Andere Namen |
Pyrimidin-2-amin | ||||||||||||||||||
| Summenformel | C4H5N3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 95,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
125 °C[3] | ||||||||||||||||||
| Siedepunkt |
158–160 °C[4] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2-Aminopyrimidin ist ein stickstoffhaltiger Heterocyclus, der sich von Pyrimidin, einem 1,3-Diazin, ableitet und eine primäre Aminogruppe trägt. Das Pyrimidin-2-amin findet sich als Stammverbindung in Agrowirkstoffen, wie z. B. in Fungiziden und Insektiziden[6] und ist ein Molekülbaustein für das Sulfonamid Sulfadiazin, das in Kombination mit einem Dihydrofolatreduktase-Inhibitor zur Therapie der Toxoplasmose, meist aber als das Silbersalz Silbersulfadiazin zur Wundbehandlung eingesetzt wird.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bei der Reaktion der aus Äpfelsäure mit 20%igem Oleum entstehenden (instabilen und daher nicht isolierten) 3-Oxopropansäure (Formylessigsäure) mit Guanidinsalzen bildet sich Isocytosin in 69%iger Ausbeute.[7][8]

Die im tautomeren Gleichgewicht vorliegende 4-Hydroxygruppe des Isocytosin kann mit Phosphoroxychlorid in stark saurem Medium durch ein Chloratom in 93%iger Ausbeute zum 2-Amino-4-chlorpyrimidin ausgetauscht werden.[9] Das Chloratom in dieser Verbindung wird mit Zinkstaub in ammoniakalischer Lösung leicht unter Bildung von 2-Aminopyrimidin (Ausbeute 90 %) entfernt.[10]
Ein alternativer Syntheseweg geht aus von β-Ethoxyacroleindiethylacetal, das in Gegenwart von starken Säuren mit Guanidinhydrochlorid mit einer Ausbeute von 53 % zu Pyrimidin-2-amin reagiert.[11][12]

Die aufwendige Darstellung des Ethoxyacroleindiethylacetals aus Acrolein durch Bromierung zum Dibrompropanal und dessen Umsetzung mit Ethanol und Chlorwasserstoff zum β-Ethoxybrompropanaldiethylacetal (64 % Ausbeute)[13] und anschließende Dehydrobromierung mit Kaliumhydroxid in Ethanol zum eigentlichen Reaktanden β-Ethoxyacroleindiethylacetal (80 % Ausbeute)[14].

sowie die insgesamt geringen Ausbeuten machen diesen Syntheseweg unökonomisch.
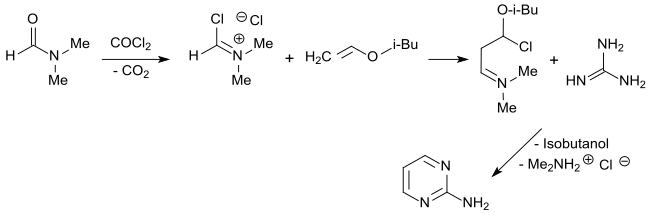
Eine auch im größeren Maßstab interessante Alternative bietet der Weg über das aus dem Vilsmeier-Salz (aus Dimethylformamid und Phosgen) mit Isobutylvinylether entstehende Malondialdehyd-Derivat, das mit Guanidinhydrochlorid in 97%iger Ausbeute 2-Aminopyrimidin bildet.[15]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Aminopyrimidin ist ein weißer kristalliner Feststoff, der sich in Wasser und polaren Lösungsmitteln löst.
Anwendungen
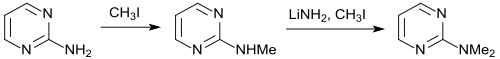
[Bearbeiten | Quelltext bearbeiten]Die Methylierung von 2-Aminopyrimidin zum 2-Methylaminopyrimidin gelingt mit Methyliodid in Ethanol in 90%iger Ausbeute. Nach Aktivierung mit Lithiumamid in Benzol kann mittels Methyliodid auch eine zweite Methylgruppe, allerdings mit geringer Ausbeute (31 %) eingeführt werden. Die Synthese des 2-Dimethylaminopyrimidins gelingt mit 88%iger Ausbeute durch Reaktion von 2-Chlorpyrimidin und Dimethylamin.[16]
2-Isopropylaminopyrimidin ist aus 2-Aminopyrimidin durch Umsetzung mit Aceton und anschließende Hydrierung mit Natriumborhydrid in 60 % Reinausbeute erhältlich.[17]

Die Verbindung wurde als Phosphatsalz auf Wirksamkeit gegen Neuropathien geprüft, aber wegen Hepatotoxizität nicht weiter verfolgt.
Aus Pyrimidin-2-amin ist durch Diazotierung in konzentrierter Salzsäure 2-Chlorpyrimidin in bescheidenen Ausbeuten (26–27 %) zugänglich[18]

und kann mit Arylaminen einfach zu 2-Arylaminopyrimidinen aminiert werden.[19]
2-Chlorpyrimidin findet auch in der letzten Stufe der Synthese des Dopaminagonisten Piribedil Verwendung.
Den gegen echten Mehltau wirksamen so genannten 2-Aminopyrimidin-Fungiziden wie z. B. die inzwischen in Deutschland nicht mehr zugelassenen Produkte Ethirimol, Dimethirimol und Bupirimat, ebenso wie den Insektiziden Pirimiphos-methyl, Primidophos oder Pyrimidate, liegt die 2-Aminopyrimidin-Struktur zugrunde.[6]
In einer Mehrkomponentenreaktion mit drei Reaktanden – einem Aldehyd, einem Isonitril und dem Amin 2-Aminopyrimidin – entsteht als Eintopfreaktion nach Ivar Karl Ugi in moderaten bis guten Ausbeuten (um 50 %) 3-Amino-imidazo[1,2-a]pyrimidin:[20]

Allerdings liefert die Reaktion nach neueren Untersuchungen ein Gemisch der 2- und 3-Aminoverbindung.[21]
Eine erneute Überarbeitung dieser Reaktion mit Toluol als unpolarem Lösungsmittel und sequentieller Zuführung der Reaktanden und Zusatz von Ammoniumchlorid als Promotor führt zu einem einheitlichen 3-Aminoprodukt in Ausbeuten um 60 %.[22]
Die wichtigste Verwendung von 2-Aminopyrimidin ist als Amin-Molekülbaustein für das Sulfonamid Sulfadiazin, das in Kombination mit Trimethoprim oder Pyrimethamin das Mittel der Wahl zur Behandlung der Toxoplasmose bei Tieren und Menschen darstellt.
Im vorletzten (n-1)-Schritt der Darstellung von Sulfadiazin wird 4-Acetamidobenzolsulfochlorid mit Pyridin-2-amin zum acetylgeschützten Sulfadiazin, das anschließend zum Endprodukt deacetyliert wird.[23]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu 2-Aminopyrimidine bei TCI Europe, abgerufen am 10. November 2017.
- ↑ Datenblatt 2-Pyrimidinamin bei Sigma-Aldrich, abgerufen am 10. November 2017 (PDF).
- ↑ R. L. Shivalkar, S. V. Sunthankar: Reaction of Lithium Aluminum Hydride with Arylaminomethylenemalonate Esters and Related Compounds 1. In: Journal of the American Chemical Society. 82. Jahrgang, Nr. 3, Februar 1960, S. 718–721, doi:10.1021/ja01488a053 (englisch, pubs.acs.org ( des vom 23. Oktober 2021 im Internet Archive) [abgerufen am 23. Oktober 2021]).
- ↑ Datenblatt 2-Aminopyrimidin zur Synthese bei Merck, abgerufen am 10. November 2017.
- ↑ a b c Datenblatt 2-Aminopyrimidine bei Alfa Aesar, abgerufen am 10. November 2017 (Seite nicht mehr abrufbar).
- ↑ a b Alan Wood, Compendium of Pesticide Common Names, http://www.alanwood.net/pesticides/index.html
- ↑ Patent US2224836: 2-Aminopyrimidines. Angemeldet am 26. April 1940, veröffentlicht am 10. Dezember 1940, Anmelder: American Cyanamid Co., Erfinder: R.O. Roblin, Jr., J.P. English.
- ↑ W.T. Caldwell, H.B. Kime: A new synthesis of isocytosine. In: J. Am. Chem. Soc. Band 62, Nr. 9, 1940, S. 2365, doi:10.1021/ja01866a028.
- ↑ Patent US2425248: Production of 2-aminopyrimidine. Angemeldet am 3. Februar 1945, veröffentlicht am 5. August 1947, Anmelder: American Cyanamid Co., Erfinder: E. Kuh, T.W. Clapper.
- ↑ Patent US2344707: Process for producing 2-aminopyrimidine. Angemeldet am 19. September 1942, veröffentlicht am 21. März 1944, Anmelder: American Cyanamid Co., Erfinder: E. Kuh.
- ↑ R.W. Price, A. Moos: A new synthesis of 2-aminopyrimidine. In: J. Am. Chem. Soc. Band 67, Nr. 2, 1945, S. 207–208, doi:10.1021/ja01218a018.
- ↑ Patent US2375735: Preparation of pyrimidines. Angemeldet am 8. November 1941, veröffentlicht am 8. Mai 1945, Anmelder: Lederle Laboratories, Inc., Erfinder: A.M. Moos, R.W. Price.
- ↑ E. Fischer, G. Giebe: Darstellung der Acetale. In: Ber. Dtsch. Chem. Ges. Band 30, Nr. 3, 1897, S. 3053–3059, doi:10.1002/cber.189703003121.
- ↑ L. Claisen: Zur Kenntnis des Propargylaldehyds und des Phenylpropargylaldehyds. In: Ber. Dtsch. Chem. Ges. Band 36, Nr. 3, 1903, S. 3664–3673, doi:10.1002/cber.19030360168.
- ↑ Patent US3974159: Manufacture of derivatives of malondialdehyde. Angemeldet am 28. April 1975, veröffentlicht am 10. August 1976, Anmelder: BASF AG, Erfinder: M. Decker, W. Schoenleben, H. Toussaint, H. Hoffmann.
- ↑ C.G. Overberger, I.C. Kogon: Monomer synthesis. Methylation of 2-aminopyrimidine. In: J. Am. Chem. Soc. Band 76, Nr. 4, 1954, S. 1065–1068, doi:10.1021/ja01633a040.
- ↑ Patent US4266057: Process for the preparation of 2-isopropylamino pyrimidine. Angemeldet am 11. Juni 1979, veröffentlicht am 5. Mai 1981, Anmelder: Expansia, Erfinder: C.G. Demosthene, C.R. Aspisi.
- ↑ I.C. Kogon, R. Minin, C.G. Overberger: 2-Chloropyrimidine In: Organic Syntheses. 35, 1955, S. 34, doi:10.15227/orgsyn.035.0034; Coll. Vol. 4, 1963, S. 182 (PDF).
- ↑ K. Walsh, H.F. Sneddon, C.J. Moody: Amination of heteroaryl chlorides: Palladium catalysis or SNAr in green solvents? In: Chemsuschem. Band 6, Nr. 8, 2013, S. 1455–1460, doi:10.1002/cssc.201300239.
- ↑ K. Groebke, L. Weber, F. Mehlin: Synthesis of Imidazo[1,2-a] annulated Pyridines, Pyrazines and Pyrimidines by a Novel Three-Component Condensation. In: Synlett. Band 1998, Nr. 6, 1998, S. 661–663, doi:10.1055/s-1998-1721.
- ↑ G.S. Mandair, M. Light, A. Russell, M. Hursthouse, M. Bradley: Re-evaluation of the outcome of a multiple component reaction – 2- and 3-amino-imidazo[1,2-a]pyrimidines? In: Tetrahedron Lett. Band 43, Nr. 23, 2002, S. 4267–4269, doi:10.1016/S-0040-4039(02)00709-8.
- ↑ V.Z. Parchinsky, O. Shuvalova, O. Ushakova, D.V. Kravchenko, M. Krasavin: Multi-component reactions between 2-aminopyrimidine, aldehydes and isonitriles: the use of a nonpolar solvent suppresses formation of multiple products. In: Tetrahedron Lett. Band 47, Nr. 6, 2006, S. 947–951, doi:10.1016/j.tetlet.2005.11.152.
- ↑ R.O. Roblin, Jr., J.H. Williams, P.S. Winnek, J.P. English: Chemotherapy. II. Some sulfanilamide heterocycles. In: J. Am. Chem. Soc. Band 62, Nr. 8, 1940, S. 2002–2005, doi:10.1021/ja01865a027.
