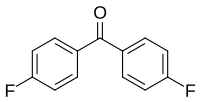
4,4′-Difluorbenzophenon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 4,4′-Difluorbenzophenon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H8F2O | |||||||||||||||
| Kurzbeschreibung |
weißer bis hellgelber kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 218,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
sehr wenig löslich in Wasser (0,00876 g·l−1 bei 20 °C)[1], löslich in Ethanol und Toluol[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
4,4′-Difluorbenzophenon ist ein Benzophenonderivat, bei dem beide der Ketongruppe gegenüber stehende Wasserstoffatome (in para-Stellung) durch Fluoratome ersetzt sind. Die Verbindung ist Ausgangsstoff für Polyetherketone, PEK und Polyetheretherketone PEEK, die sich durch hohe Glasübergangs- und sehr hohe Schmelztemperaturen (Tm > 330 °C) auszeichnen.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese von 4,4′-Difluorbenzophenon wurde erstmals 1933 berichtet.[4] Bei der Friedel-Crafts-Acylierung von Fluorbenzol mit dem Säurechlorid der 4-Fluorbenzoesäure in Gegenwart des Acylierungskatalysators Aluminiumchlorid AlCl3 entsteht in 52%iger Ausbeute 4,4′-Difluorbenzophenon neben geringen Mengen des isomeren 2,4′-Difluorbenzophenons.

Bei Verwendung eines Gemischs aus Aluminiumchlorid und Lithiumchlorid in 1,2-Dichlorethan wird 4,4′-DFBP in 94,5%iger Ausbeute und 97,2%iger Reinheit erhalten.[5]
Der erforderliche Einsatz überstöchiometischer Mengen des Acylierungskatalysators AlCl3 und die Kosten der Entsorgung seiner Hydrolyseprodukte haben bereits früh die Suche nach alternativen Synthesewegen stimuliert.
Diazotierung von 4,4′-Diaminodiphenylmethan in 95%iger wässriger Flusssäure liefert als Zwischenprodukt 4,4′-Difluordiphenylmethan, das durch mehrstündiges Erhitzen mit überschüssigem Natriumnitrit in einer Reinausbeute von 78 % zu 4,4′-Difluorbenzophenon oxidiert werden kann.[6]
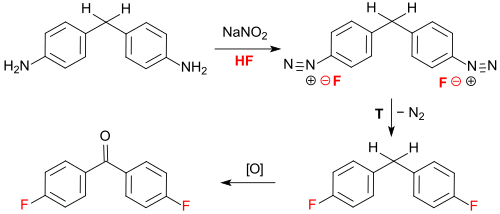
Die Verwendung von hochkonzentrierter Flusssäure ist aus verfahrens- und sicherheitstechnischen Gesichtspunkten problematisch.
Bei der thermischen Zersetzung (Balz-Schiemann-Reaktion) des als Feststoff isolierten Tetrafluorboratsalzes des diazotierten 4,4′-Diaminodiphenylmethans entsteht unter Stickstoff- und Bortrifluoridabspaltung 4,4′-Difluordiphenylmethan,[7] dessen Methylengruppe wiederum zum Keton 4,4′-DFBP oxidiert wird.

Ein weiteres Verfahren nutzt die mit Fluorbenzolsulfonsäure säurekatalysierte Reaktion von Formaldehyd mit Fluorbenzol zu einem Difluordiphenylmethan-Gemisch, das zu 77 % aus 4,4′-DFBP und zu 23 % aus dem isomeren 2,4′-DFBP besteht. Das Gemisch wird mit konzentrierter Salpetersäure oxidiert und durch Umkristallisieren mit einem Eisessig/Wasser-Gemisch 9:1 gereinigt. Dreimaliges Umkristallisieren liefert 4,4′-DFBP in 99,5%iger Reinheit.[8]
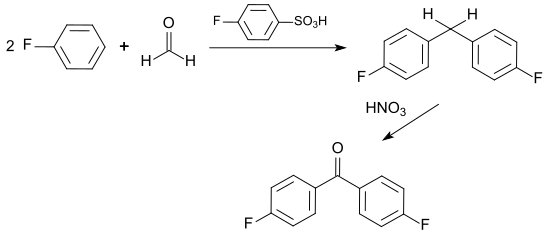
Angesichts fehlender Angaben zur Ausbeute der einzelnen Prozessstufen, des hohen Anteils an unerwünschtem Isomeren und deren aufwendiger Abtrennung scheint dieser Syntheseweg wenig brauchbar zu sein.
Wegen der hohen Reinheitsanforderungen an 4,4′-DFBP als Monomer für Polykondensationsreaktionen und der teuren eingesetzten Fluoraromaten wurden weitere Alternativrouten zu 4,4′-Difluorbenzophenon vorgeschlagen, die aber keine industrielle Anwendung gefunden haben. Nebenprodukte, insbesondere das unerwünschte Isomer 2,4′-DFBP und die bei Einsatz von Natriumnitrit und Salpetersäure entstehenden Nitroaromaten, müssen vor der Verwendung von 4,4′-DFBP als Monomer möglichst quantitativ abgetrennt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]4,4′-Difluorbenzophenon ist ein geruchloses weißes Kristallpulver, das sich in Ethanol und Toluol löst. Verunreinigungen, wie z. B. das häufigste Nebenprodukt 2,4′-Difluorbenzophenon, können durch (mehrfaches) Umkristallisieren aus Cyclohexan[9] oder aus einem 80:20-Ethanol:Wasser-Gemisch entfernt werden.[6]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]4,4′-Difluorbenzophenon ist ein Schlüsselrohstoff für das Polyetheretherketon PEEK, den mit Abstand wichtigsten thermoplastischen Hochleistungskunststoff aus der Klasse der Polyaryletherketone PAEK.
Die Polykondensation zwischen 4,4′-Difluorbenzophenon und dem mit Alkalicarbonaten, z. B. Kaliumcarbonat gebildeten Alkalimetallsalz von Hydrochinon zu PEEK findet in Diphenylsulfon als Lösungsmittel durch stufenweises Erhitzen unter Schutzgas bis auf 320 °C statt.[10]

Dabei wird ein fast farbloses Polymer mit Tg von ca. 140 °C und Tm von 334 °C gebildet.
PEEK findet wegen seiner außerordentlichen thermischen Stabilität von −196 bis +260 °C, seiner hohen Lösemittelresistenz und chemischen Beständigkeit, sowie seiner guten Bioverträglichkeit zunehmend Verwendung als Metallersatzmaterial.[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j Datenblatt 4,4′-Difluorobenzophenone bei Sigma-Aldrich, abgerufen am 2. Mai 2019 (PDF).
- ↑ a b Eintrag zu 4,4'-Difluorobenzophenone bei TCI Europe, abgerufen am 2. Mai 2019.
- ↑ Datenblatt 4,4'-Difluorobenzophenone, 98 % bei Alfa Aesar, abgerufen am 2. Mai 2019 (Seite nicht mehr abrufbar).
- ↑ R.D. Dunlop, J.H. Gardner: The preparation of 4-fluoro- and 4,4′-difluorobenzophenone. In: J. Am. Chem. Soc. Band 55, Nr. 4, 1933, S. 1665–1666, doi:10.1021/ja01331a058.
- ↑ Patent US4814508: Friedel-Crafts preparation of aromatic ketones. Angemeldet am 21. März 1988, veröffentlicht am 21. März 1989, Anmelder: Raychem Corp., Erfinder: H.C. Gors, P.J. Horner, J. Jansons.
- ↑ a b Patent EP0004710B1: Preparation of 4,4'-difluorobenzophenone. Angemeldet am 8. März 1979, veröffentlicht am 4. November 1981, Anmelder: Imperial Chemical Industries PLC, Erfinder: P.A. Staniland, R.D. Bowden, L. Burgess, R.J. Clark.
- ↑ R.E. Banks, ed.: Fluorine Chemistry at the Millenium – Fascinated by Fluorine. Elsevier, Amsterdam 2000, ISBN 0-08-043405-3, S. 177.
- ↑ Patent US7687668B2: Process for preparing 4,4'-difluorobenzophenone. Angemeldet am 27. Juli 2006, veröffentlicht am 30. März 2010, Anmelder: Evonik Fibres GmbH, Erfinder: H. Rögl, M. Ungerank.
- ↑ Patent US5777172: Process for the preparation of benzophenthiones and benzophenones. Angemeldet am 16. Mai 1995, veröffentlicht am 7. Juli 1998, Anmelder: Zeneca Ltd., Erfinder: M.C.H. Standen, N.C. Evens.
- ↑ Patent EP0001879A1: Thermoplastic aromatic polyetherketones, a method for their preparation and their application as electrical insulants. Angemeldet am 22. Juni 1978, veröffentlicht am 16. Mai 1979, Anmelder: Imperial Chemical Industries Ltd., Erfinder: J.B. Rose, P.A. Staniland.
- ↑ Polyaryletherketone (PAEK). In: SPECIAL K 2016 Welt der Kunststoffe. Carl Hanser Verlag, Oktober 2016, archiviert vom (nicht mehr online verfügbar) am 26. Mai 2019; abgerufen am 5. Mai 2018.

