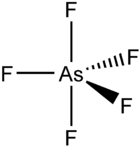
Arsen(V)-fluorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Arsen(V)-fluorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | AsF5 | |||||||||||||||
| Kurzbeschreibung |
farbloses, an Luft rauchendes Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 169,91 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
2,14 g·cm−3 (flüssig am Siedepunkt)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−52,8 °C[2] | |||||||||||||||
| Löslichkeit |
löslich in Ethanol, Diethylether und Benzol[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Arsenpentafluorid, AsF5, ist eine chemische Verbindung bestehend aus den Elementen Arsen und Fluor, in der Arsen die Oxidationsstufe +V besitzt. Es ist ebenso wie Antimon(V)-fluorid eine starke Lewis-Säure, ein Fluorierungs- und Oxidationsmittel.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Arsenpentafluorid kann durch Reaktion direkt aus den Elementen dargestellt werden.[3]
Weitere Methoden sind die Fluorierung von Arsen(III)-fluorid oder Arsenoxiden mit elementarem Fluor.
Es kann auch ohne den Einsatz von elementarem Fluor aus Arsentrifluorid und Antimonpentafluorid mit Brom als Katalysator erhalten werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Arsenpentafluorid ist bei Raumtemperatur ein farbloses Gas. Es besitzt eine trigonal-bipyramidale Geometrie.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Durch Wasser wird Arsenpentafluorid hydrolysiert. Es geht durch Reaktion mit Fluorid-Donatoren wie mit Schwefeltetrafluorid in das oktaedrisch gebaute Hexafluoroarsenat(V) über:
- .
Mit Xenondifluorid werden je nach Mischungsverhältnis verschiedene ionische Verbindungen gebildet.[5]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Otto Ruff, A. Braida, O. Bretschneider, W. Menzel, H. Plaut: Die Darstellung, Dampfdrucke und Dichten des BF3, AsF5 und BrF3. In: Zeitschrift für anorganische und allgemeine Chemie. 206, 1932, S. 59–64, doi:10.1002/zaac.19322060108.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Arsenfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- ↑ a b c d e Eintrag zu Arsenpentafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 198–9.
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Arsenverbindungen, mit Ausnahme der namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Ralf Steudel: Chemie der Nichtmetalle, Synthesen – Strukturen – Bindung – Verwendung, 4. Auflage, 2014 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-030439-8, S. 570, (abgerufen über De Gruyter Online).







![{\displaystyle \mathrm {AsF_{5}+SF_{4}\longrightarrow SF_{3}^{+}[AsF_{6}]^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ee1d1d083216e6e15ff78f052c1dc1358037ee2)
![{\displaystyle \mathrm {2\,XeF_{2}+AsF_{5}\rightarrow [Xe_{2}F_{3}][AsF_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7908536e1314d65cc30c1cbcee6f034181c805e7)
![{\displaystyle \mathrm {XeF_{2}+AsF_{5}\rightarrow [XeF][AsF_{6}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a90aabf3a158d87480222a600ccd1d47c1f21d15)
![{\displaystyle \mathrm {XeF_{2}+2\,AsF_{5}\rightarrow [XeF][As_{2}F_{11}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4059be4656983f8a65dc2d53e40cdd0db85c91bc)