Isatin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Isatin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C8H5NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
orangeroter Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 147,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Isatin ist eine organische Verbindung und ein Derivat des Indols.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Isatin wurde erstmals von dem französischen Chemiker Auguste Laurent isoliert, erst 1878 gelang Adolf von Baeyer die Totalsynthese. 1880 entwickelte er einen Syntheseweg ausgehend von o-Nitrozimtsäure, 1883 patentierte er einen Syntheseweg aus 2-Nitrobenzaldehyd. Infolgedessen musste Indigo nicht mehr umständlich aus Pflanzen gewonnen werden.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Früher konnte Isatin nur aus Indigo gewonnen werden. Heute wird es aus Benzoesäure-Derivaten oder durch das Verfahren nach Sandmeyer hergestellt.[4][5]
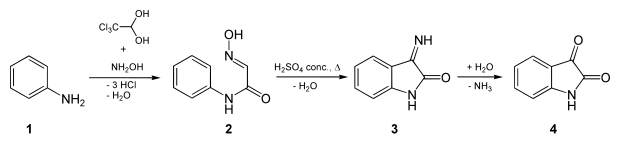
Anilin (1) wird in Gegenwart von Chloralhydrat und Hydroxylamin, welche das entsprechende Oxim bilden, zu α-Isonitrosoacetanilid (Hydroxyaminoacetanilid, 2) umgesetzt. Durch Einwirken von konz. Schwefelsäure cyclisiert dieses zu Isatin-3-imid (3) und wird dann schließlich zu Isatin (4) verseift.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Isatin ist in kaltem Wasser mäßig und in heißem Wasser besser mit oranger Farbe löslich. In Ethanol ist Isatin mit rot-oranger Farbe gut löslich. Gibt man zu der erwärmten wässrigen Lösung etwas Natriumcarbonat (alkalische Wirkung), so ändert sich die Farbe durch Deprotonierung nach rot-violett. Bei Zugabe von Natriumdithionit zu der Lösung wird diese hellgelb bis farblos. Hierbei findet eine Reduktion zur Leukoform, es entsteht das entsprechende Diol, statt, die sich durch ein geeignetes Oxidationsmittel (z. B. auch Luftsauerstoff) wieder zum Dion oxidieren lässt. Somit ist dieser Vorgang ein Beispiel für die Küpenfärberei.[7] Die Zersetzungstemperatur liegt bei >193 °C, der Flammpunkt bei 200 °C.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Isatin und seine Derivate sind wichtige Ausgangsverbindungen für Indigo (dem Farbstoff der Bluejeans) und indigoähnlicher Farbstoffe. Auch einige Pharmaka wurden aus Isatin und seinen Derivaten hergestellt. Isatin selbst ist dabei ein endogener MAO-Hemmer. Heutzutage werden Isatin-Derivate wegen ihrer leberschädigenden Wirkung nicht mehr in der pharmazeutischen Industrie verwendet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ISATIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Juni 2020.
- ↑ a b Eintrag zu Isatin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- ↑ a b c d e Eintrag zu Isatin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ T. Sandmeyer: Über Isonitrosoacetanilide und deren Kondensation zu Isatinen. In: Helv. Chim. Acta. 2 (1), 1919, S. 234–242, doi:10.1002/hlca.19190020125.
- ↑ C. S. Marvel, G. S. Hiers: Isatin In: Organic Syntheses. 5, 1925, S. 71, doi:10.15227/orgsyn.005.0071; Coll. Vol. 1, 1941, S. 327 (PDF).
- ↑ Hans Beyer, Wittko Francke, Wolfgang Walter: Lehrbuch der Organischen Chemie. 24., überarb. Auflage. Hirzel, Stuttgart 2004, ISBN 3-7776-1221-9, S. 776–777.
- ↑ Römpp: Basislexikon Chemie. Georg Thieme Verlag, Stuttgart 1998, ISBN 3-13-115711-9.