N-Hydroxysulfosuccinimid-Natriumsalz
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Strukturformel des Natriumsalzes ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | N-Hydroxysulfosuccinimid-Natriumsalz | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H4NNaO6S | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 217,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser und organischen Lösungsmitteln[3], wie z. B. N,N-Dimethylformamid[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
N-Hydroxysulfosuccinimid-Natriumsalz (Sulfo-NHS) ist das Additionsprodukt von N-Hydroxymaleinimid und durch Hydrolyse in wässriger Lösung aus Natriumdisulfit Na2S2O5 entstehendem Natriumhydrogensulfit NaHSO3.
Wie N-Hydroxysuccinimid, 1-Hydroxybenzotriazol oder 1-Hydroxy-7-azabenzotriazol eignet sich Sulfo-NHS zur Bildung von so genannten aminreaktiven Aktivestern mit Carbonsäuren oder geschützten Aminosäuren zur Modifizierung, Immobilisierung und Verknüpfung (engl. cross-linking) von Peptiden und Proteinen.[5]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die ursprüngliche Synthese von Sulfo-NHS aus dem nur über mehrere Stufen zugänglichen N-Hydroxymaleinimid[6] ist sehr zeitaufwendig (>50 Tage) und liefert nur bescheidene Ausbeuten (25–28 % bezogen auf das Edukt Maleinsäureanhydrid). Auch nach umständlicher Reinigung durch mehrfaches Umkristallisieren wird ein mit 3 bis 5 % Sulfosuccinimid-Natriumsalz verunreinigtes amorphes Zielprodukt erhalten.
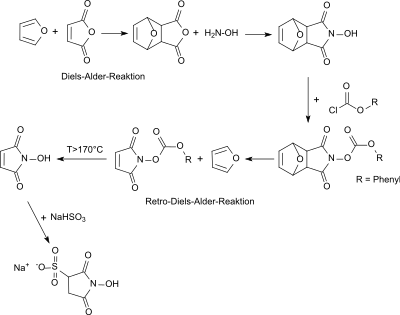
Auch die Direktsynthese aus N-Hydroxymaleinimid und Natriumdisulfit liefert offensichtlich nur ein verunreinigtes und sehr hygroskopisches N-Hydroxysulfosuccinimid Natriumsalz.[7]

Einen direkteren Zugang zu Sulfo-NHS ermöglicht die Reaktion von Sulfobernsteinsäure[8] über das Natriumsalz des Sulfobernsteinsäureanhydrids mit Hydroxylamin zum Natriumsalz der Sulfobernsteinsäure-monohydroxamsäure, das mit Acetanhydrid zu N-Hydroxysulfosuccinimid Natriumsalz cyclisiert.

Statt über das Natriumsalz des Sulfobernsteinsäureanhydrid kann Sulfo-NHS auch durch Umsetzung von Sulfobernsteinsäurediestern mit Hydroxylamin hergestellt werden[9] Der Syntheseweg ausgehend von Sulfobernsteinsäure führt zu weitgehend von Sulfosuccinimid-Na freiem Sulfo-NHS als racemisches Gemisch.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]N-Hydroxysulfosuccinimid Natriumsalz fällt bei der Synthese meist als amorpher hellgelber und hygroskopischer Feststoff an. Nach Umkristallisation aus 20%iger Essigsäure wird es als weiße, kristalline Substanz erhalten. Sulfo-NHS ist in Wasser und in polaren organischen Lösungsmitteln wie z. B. DMF löslich.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Wie N-Hydroxysuccinimid mit Carbonsäuren unter Wasserabspaltung durch Carbodiimide, wie z. B. 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimid (EDC) zum NHS-Aktivester umgesetzt werden kann, so reagiert N-Hydroxysulfosuccinimid Natriumsalz zum analogen Sulfo-NHS-Ester. Aktivester bilden mit primären Aminogruppen (z. B. von Lysin-Seitenketten in Proteinen) in hohen Ausbeuten Carbonsäureamide und haben sich insbesondere in der Biochemie zum Aufbau von Peptiden und zur chemischen Vernetzung von Proteinen bewährt.
Die Aktivierung von Carbonsäuren vor der Umsetzung mit N-Hydroxysuccinimid Natriumsalz kann auch durch Reaktion mit Triphosgen erfolgen.[10] Dabei werden Sulfo-NHS-Aktivester schnell unter milden Bedingungen und in hohen Ausbeuten erhalten.
Die bei 4 °C in wasserfreier Form recht stabilen Sulfo-NHS-Aktivester können isoliert und somit die Amidierung in zwei separaten Reaktionsschritten durchgeführt werden.[11][12]
Die Aktivierungsreaktion von EDC und N-Hydroxysulfosuccinimid Natriumsalz wird bevorzugt bei schwach saurem pH-Wert (pH 4,5–7,2), während die Amidierung am besten bei physiologischem pH-Wert von 7 bis 8 abläuft.[13]
Während die Aktivierung mit NHS zu weniger wasserlöslichen Aktivestern führt, sind Sulfo-NHS-Aktivester durch die sehr hydrophile Sulfonsäuregruppe besser wasserlöslich und sehr viel polarer, wodurch sie Biomembranen nicht mehr durchdringen dringen.[6] Dadurch können selektiv primäre Aminogruppen an Proteinen auf der äußeren Oberfläche von Membranen unter physiologischen Bedingungen modifiziert werden.
Mit zweifach funktionalen Ausgangsverbindungen, z. B. α,ω-Dicarbonsäuren, entstehen so genannte homobifunktionelle Sulfo-NHS-Ester als vernetzendem Abstandshalter (englisch spacer), bei denen die Anzahl der Methylengruppen zwischen den Carboxylendgruppen die Länge des Spacers bestimmt.
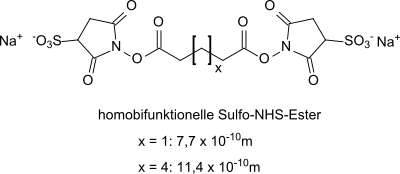
Aus zweifach funktionalen Ausgangsverbindungen mit verschiedenartigen Endgruppen sind so genannte heterobifunktionelle Vernetzer zugänglich, die neben der aminreaktiven Sulfo-NHS-Gruppe an einem Molekülende eine sulfhydrylreaktive Maleinimid-Gruppe am anderen Molekülende aufweisen.[5]

Mit solchen Kopplungsreagenzien können sequentielle Verknüpfungsreaktionen mit verschiedenen funktionellen Gruppen durchgeführt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu N-Hydroxysulfosuccinimide sodium salt bei Thermo Fisher Scientific, abgerufen am 22. September 2023.
- ↑ a b Datenblatt N-Hydroxysulfosuccinimid Natriumsalz bei Sigma-Aldrich, abgerufen am 17. Mai 2015 (PDF).
- ↑ Uptima, NHS / sulfo-NHS
- ↑ C.W. Lim, H.T. Le, J.H. Han, D.-H. Kim, J.G. Jang, T.W. Kim: New water-soluble alkynylating agent for cell surface protein: sulfosuccininimidyl-4-pentynoate (Supporting Information). In: Bull. Korean Chem. Soc. Band 34, Nr. 6, 2013, S. 1895–1898 (kcsnet.or.kr).
- ↑ a b Thermo Scientific, Crosslinking Technical Handbook.
- ↑ a b J.V. Staros: N-Hydroxysuccinimide active esters: Bis(N-hydroxysulfosuccinimide) esters of two dicarboxylic acids are hydrophilic, membrane-impermeant protein cross-linkers. In: Biochemistry. Band 21, Nr. 17, 1982, S. 3950–3955, doi:10.1021/bi00260a008.
- ↑ P.A. Huber, Entwicklung photoaktivierbarer fluoreszierender Reagenzien zur Markierung hydrophiler intrazellulärer Phasen, Dissertation ETH-Zürich, 1986, S. 33, PDF
- ↑ Patent US5892057: Preparation of sulfo-N-hydroxysuccinimide salts. Angemeldet am 18. September 1997, veröffentlicht am 6. April 1999, Anmelder: Pierce Chemical Co., Erfinder: M.C. Wilkes, M.L. Bremmer.
- ↑ Patent US5872261: Preparation of sulfo-N-hydroxysuccinimide salts with intermediate formation of diester. Angemeldet am 18. September 1997, veröffentlicht am 16. Februar 1999, Anmelder: Pierce Chemical Co., Erfinder: M.L. Bremmer, M.C. Wilkes.
- ↑ M. Kim, K.-J. Han: Convenient synthesis of N-hydroxysuccinimide esters from carboxylic acids using triphosgene. In: Synth. Commun. Band 39, Nr. 24, 2009, S. 4467–4472, doi:10.1080/00397910902906628.
- ↑ Thermo Scientific, Instructions: NHS and Sulfo-NHS ( vom 28. Mai 2015 im Internet Archive)
- ↑ J.V. Staros, R.W. Wright, D.M. Swindle: Enhancement by N-hydroxysulfosuccinimide of water-soluble carbodiimide-mediated coupling reactions. In: Anal. Biochem. Band 156, Nr. 1, 1986, S. 220–222, doi:10.1016/0003-2697(86)90176-4.
- ↑ Z. Grabarek, J. Gergely: Zero-length crosslinking procedure with the use of active esters. In: Anal. Biochem. Band 185, 1990, S. 131–135, doi:10.1016/0003-2697(90)90267-D.
