Pinocamphone
Die Pinocamphone (auch: Pinocamphene) sind eine Gruppe chemischer Verbindungen, die in der Natur vor allem im Ysop-Öl vorkommen und zu den bicyclischen Monoterpenketonen zählen.
Vertreter
[Bearbeiten | Quelltext bearbeiten]| Pinocamphone | |||||
| Name | (+)-Pinocamphon | (−)-Pinocamphon | (+)-Isopinocamphon | (−)-Isopinocamphon | |
| Strukturformel | 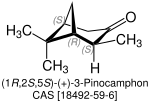
|

|

|

| |
| Strukturformel | 
|

|

|

| |
| Andere Namen | (1R,2S,5S)-Pinocamphon | (1S,2R,5R)-Pinocamphon | (1R,2R,5S)-Pinocamphon | (1S,2S,5R)-Pinocamphon | |
| 3-Pinanon 2,6,6-Trimethylbicyclo[3.1.1]heptan-3-on | |||||
| CAS-Nummer | 18492-59-6 | 22339-21-5 | 473-62-1 | 14575-93-0 | |
| 547-60-4 (Racemat) | 15358-88-0 (Racemat) | ||||
| PubChem | 11038 | ||||
| Summenformel | C10H16O | ||||
| Molare Masse | 152,23 g·mol−1 | ||||
| Aggregatzustand | flüssig | ||||
| Kurzbeschreibung | |||||
| Siedepunkt | 211–213 °C[1] | ||||
| Dichte | 0,96 g·cm−3[1] | ||||
| Brechungsindex | 1,472 (21 °C)[1] | ||||
| GHS- Kennzeichnung |
| ||||
| H- und P-Sätze | siehe oben | ||||
| siehe oben | |||||
| siehe oben | |||||
| Toxikologische Daten | >250 mg·kg−1 (LD50, Maus, oral)[2] | ||||
Vorkommen
[Bearbeiten | Quelltext bearbeiten]

Die Pinocamphone und strukturell ähnliche Verbindungen machen bis zu 70 Prozent des Ysop-Öls (Hyssopi aetherolum) aus.[3] Darunter sind zwischen 7 und 25 % 1-Pinocamphon, 16 bis 22 % Isopinocamphon, 10 bis 23 % Pinocarvon und 7 bis 11 % Pinen. Pinocamphon und Isopinocamphon werden für die toxischen Wirkungen des Ysopöls verantwortlich gemacht.[4] Sie kommen auch in anderen Naturstoffen wie Labdanum vor.[2] Da Pinocamphon krebserregend ist, ist in den USA die Verwendung von Ysopöl als Duftstoff verboten.[5]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Pinocamphon wurde erstmals 1892 von Otto Wallach durch Reduktion von Nitrosopinen mit Zink in einer Essigsäurelösung gewonnen.[1] Jedoch wurde das natürliche Vorkommen erst 1908 von Schimmel & Co. entdeckt.[6]
Die Verbindung kann auch durch Thermolyse von α-Pinenepoxid in Isopropylalkohol in Abwesenheit von Wasser gewonnen werden.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d The Terpenes Volume II The Dicyclic Terpenes, Sesquiterpenes and their Derivatives. 1932, S. 194 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Robert Tisserand, Rodney Young: Essential Oil Safety A Guide for Health Care Professionals. Elsevier Health Sciences, 2013, ISBN 978-0-7020-5434-1, S. 621 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ OHLOFF: Irdische Düfte — Himmlische Lust Eine Kulturgeschichte der Duftstoffe. Springer-Verlag, 2013, ISBN 978-3-0348-6160-1, S. 82 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Franz von Bruchhausen: Hagers Handbuch der Pharmazeutischen Praxis. Springer-Verlag, 1998, ISBN 3-540-52688-9, S. 870 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Panda: Cultivation and Utilization of Aromatic Plants. ASIA PACIFIC BUSINESS PRESS Inc., 2005, ISBN 81-7833-027-X (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ The Terpenes Volume II The Dicyclic Terpenes, Sesquiterpenes and their Derivatives. 1932, S. 192 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Vladimir Anikeev, Maohong Fan I: Supercritical Fluid Technology for Energy and Environmental Applications. Newnes, 2013, ISBN 978-0-444-62697-4, S. 72 (eingeschränkte Vorschau in der Google-Buchsuche).