Protein-DNA-Interaktion
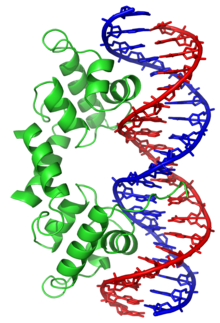
Eine Protein-DNA-Interaktion bezeichnet eine Bindung von einem Protein an DNA. Dadurch werden verschiedene Prozesse der DNA-Replikation, der Genexpression und der Epigenetik gesteuert.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Proteine, die eine Wechselwirkung mit DNA eingehen, werden als DNA-bindende Proteine bezeichnet, z. B. Proteine der DNA-Biosynthese, Transkriptionsfaktoren, DNA-modifizierende Enzyme oder Proteine der DNA-Reparatur. Meistens erfolgt eine Bindung an die große Furche von B-DNA.[1] Die Interaktionen können in sequenzspezifische und sequenzunabhängige Protein-DNA-Interaktionen eingeteilt werden. Zu den DNA-bindenden Proteinen, deren Sequenzspezifität im Zuge eines Proteindesigns gezielt verändert werden, gehören z. B. die Zinkfingernukleasen oder die Transcription activator-like effector nucleases (TALEN).[2]
Analog definierte Interaktionen sind z. B. Protein-Lipid-Interaktionen, Protein-RNA-Interaktionen und Protein-Protein-Interaktionen.
Nachweisverfahren
[Bearbeiten | Quelltext bearbeiten]Verschiedene Methoden können zur Charakterisierung (DNA-Sequenz, DNA-bindende Proteine) verwendet werden.[3] Dazu gehören unter anderem die Ligandenbindungstests zur Bestimmung der Affinität, wie der Filterbindungstest[4] und der Electrophoretic Mobility Shift Assay, die Elektronenmikroskopie,[5] die ChIP,[6] die ChIP-on-Chip, die ChIP-Seq, der DNase Footprinting Assay, die Oberflächenplasmonenresonanzspektroskopie, das Yeast-One-Hybrid-System (Y1H),[7] das Bacterial-One-Hybrid-System (B1H) und das DamID. Der Southwestern Blot erlaubt mit Hilfe spezifischer markierter DNA den Nachweis von DNA-bindenden Proteinen die zuvor durch eine SDS-PAGE aufgetrennt wurden. Daneben kann eine Strukturaufklärung per Röntgenstrukturanalyse oder per NMR-Spektroskopie erfolgen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ C. A. Bewley, A. M. Gronenborn, G. M. Clore: Minor groove-binding architectural proteins: structure, function, and DNA recognition. In: Annu. Rev. Biophys. Biomol. Struct. 27. Jahrgang, 1998, S. 105–131, doi:10.1146/annurev.biophys.27.1.105, PMID 9646864.
- ↑ K. J. Clark, D. F. Voytas, S. C. Ekker: A TALE of two nucleases: gene targeting for the masses? In: Zebrafish. 8. Jahrgang, Nr. 3, September 2011, S. 147–149, doi:10.1089/zeb.2011.9993, PMID 21929364.
- ↑ Y. H. Cai, H. Huang: Advances in the study of protein-DNA interaction. In: Amino acids. Band 43, Nummer 3, September 2012, S. 1141–1146, doi:10.1007/s00726-012-1377-9. PMID 22842750.
- ↑ Arthur. D. Riggs, Suzanne Bourgeois, Ronald F. Newby, Melvin Cohn DNA binding of the lac repressor. In: Journal of Molecular Biology Band 34, Nummer 6, 1968, 365–368, doi:10.1016/0022-2836(68)90261-1, PMID 4938552
- ↑ C. Brack: DNA electron microscopy. In: CRC critical reviews in biochemistry. Band 10, Nummer 2, 1981, S. 113–169, PMID 6163590 (Review).
- ↑ T. Sahr, C. Buchrieser: Co-immunoprecipitation: protein-RNA and protein-DNA interaction. In: Methods in molecular biology (Clifton, N.J.). Band 954, 2013, S. 583–593, doi:10.1007/978-1-62703-161-5_36, PMID 23150422.
- ↑ B. Deplancke, A. Mukhopadhyay, W. Ao, A. M. Elewa, C. A. Grove, N. J. Martinez, R. Sequerra, L. Doucette-Stamm, J. S. Reece-Hoyes, I. A. Hope, H. A. Tissenbaum, S. E. Mango, A. J. Walhout: A gene-centered C. elegans protein-DNA interaction network. In: Cell. Band 125, Nummer 6, Juni 2006, S. 1193–1205, doi:10.1016/j.cell.2006.04.038, PMID 16777607.