Strontiumbromat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 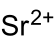
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Strontiumbromat | ||||||||||||||||||
| Summenformel | Sr(BrO3)2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis leicht gelbe, hygroskopische Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse |
| ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,773 g·cm−3[1] (Monohydrat) | ||||||||||||||||||
| Schmelzpunkt |
240 °C (Zersetzung)[1] | ||||||||||||||||||
| Löslichkeit |
373 g·l−1 (25 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Strontiumbromat ist das Strontiumsalz der Bromsäure.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Strontiumbromat kann durch Auflösen von Strontiumcarbonat in Bromsäure hergestellt werden.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Strontiumbromat ist gut wasserlöslich: 1000 g gesättigter Lösung enthalten bei 0 °C 183,2 g, bei 25 °C 272,5 g und bei 104 °C 410 g. Es tritt üblicherweise als Monohydrat Sr(BrO3)2 · H2O auf, das sich bei 75,5 °C unter Kristallwasserabgabe in das Anhydrat umwandelt.[4]
Das Monohydrat kristallisiert im monoklinen Kristallsystem in der Raumgruppe I2/c (Raumgruppen-Nr. 15, Stellung 8) mit den Gitterparametern a = 8,8742 Å, b = 7,609 Å, c = 9,3748 Å und β = 91,27°.[5] Die Kristalle sind isomorph zu Bariumbromat.[6]
Beim Erhitzen zersetzt sich Strontiumbromat bei 240 °C[7] in Strontiumbromid und Sauerstoff.[8]
Wie alle Bromate kann Strontiumbromat als Oxidationsmittel eingesetzt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Dale L. Perry, Sidney L. Phillips: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 387 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Verlag S. Hirzel, Bd. 2, 1908. S. 223 (Volltext).
- ↑ William F. Linke: The Solubility of the Strontium Halates. In: J. Am. Chem. Soc. 1953, 75(23), p. 5797-5800. doi:10.1021/ja01119a009.
- ↑ D. L. Sastry, M. V. Rajasekharan, K. V. S. Rama Rao: An X-ray study of strontium bromate monohydrate. In: Zeitschrift für Kristallographie 1980, 152(3-4), S. 333–334. doi:10.1524/zkri.1980.152.3-4.333
- ↑ L. K. Templeton, D. H. Templeton: Structure of barium bromate monohydrate. In: Acta Cryst. 1989, C45, S. 672–673. doi:10.1107/S0108270188013071.
- ↑ Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 94 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ C. Rammelsberg: Ueber die Bromsäure und deren Salze. In: Pogg. Ann. 1841, 52, S. 79–97 (Volltext).

