Symbiodiniaceae
| Symbiodiniaceae | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
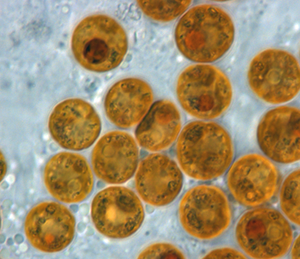
Symbiodinium | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Symbiodiniaceae | ||||||||||||
| Fensome et al., 1993[3][4] |
Die Symbiodiniaceae sind eine Familie von Dinoflagellaten, die die größte und am weitesten verbreitete Gruppe der bekannten endosymbiotisch lebenden Dinoflagellaten umfasst. Diese einzelligen Algen leben häufig im Endoderm von tropischen Nesseltieren wie Steinkorallen, Oktokorallen, Seeanemonen und Quallen, wo die Produkte ihrer Photosynthese-Aktivität im Wirt gegen anorganische Moleküle ausgetauscht werden. Sie werden auch von verschiedenen Arten von Schwämmen, Plattwürmern, Mollusken (wie den Riesenmuscheln), Foraminiferen (wie den Soritacea) und einigen Wimpertierchen beherbergt.
Im Jahr 2018 wurde die Systematik dieser Familie überarbeitet und die in der größten und hochgradig diversen Gattung Symbiodinium identifizierten Kladen wurden in sieben Gattungen eingeteilt; nach dieser Überarbeitung ist der Name Symbiodinium nun sensu stricto (in engen Sinn) ein Gattungsname nur für die Arten, die zuvor in die provisorisch als Symbiodinium „Klade A“ bezeichnete Gruppe fielen. Für die anderen (zu diesem Zeitpunkt identifizierten) Kladen wurden neue taxonomisch eigenständige Gattungen geschaffen.[5]
Neuordnung
[Bearbeiten | Quelltext bearbeiten]


Die Anerkennung der Artenvielfalt in der Gattung Symbiodinium bzw. Familie Symbiodiniaceae blieb viele Jahrzehnte lang problematisch, da es schwierig war, die dafür nötigen morphologischen und biochemischen Merkmale zu identifizieren.[7]
Bereits die frühesten ribosomalen Gensequenzdaten deuteten darauf hin, dass die Gattung Symbiodinium in ihrer herkömmlichen Form Abstammungslinien vereinte, deren genetische Divergenz ähnlich wie bei anderen Dinoflagellaten aus verschiedenen Gattungen, Familien und sogar Ordnungen war.[38] Diese große phylogenetische Disparität zwischen den Kladen A, B, C etc. (alle überkommenerweise zu Symbiodinium gerechnet) wurde durch Analysen der Sequenzen des mitochondrialen Genoms (Mitogenom oder Chondriom genannt) bestätigt.[8] Die meisten dieser Kladen umfassen zahlreiche isolierte, genetisch unterschiedliche Linien, die zudem unterschiedliche ökologische und biogeografische Verteilungen aufweisen.
Systematik
[Bearbeiten | Quelltext bearbeiten]Als Konsequenz wurden 2018 die Mitglieder der überkommenen Gattung Symbiodinium s. l. in zunächst sieben neue Gattungen innerhalb der Familie Symbiodiniaceae aufgeteilt, so dass die Anfangsbuchstaben dieser Gattungen mit den Buchstaben der Kladen übereinstimmen; die mit Nummern gekennzeichneten Subkladen (Subtypen) entsprechen dann taxonomisch meist einzelnen Arten (Spezies) dieser Gattungen.[5] Die neuen Gattungen finden sich in der AlgaeBase, die als Grundlage für die hier angegebene Systematik dient:
Familie: Symbiodiniaceae Fensome, Taylor, Norris, Sarjeant, Wharton & Williams, 1993[3][9][4]
- Gattung: Symbiodinium Freudenthal, 1962[10] (sensu stricto, Klade A) – Details siehe Hauptartikel.
- B. aenigmaticum (J.E.Parkinson, Coffroth & LaJeunesse) J.E.Parkinson & LaJeunesse 2018 (früher Symbiodinium aenigmaticum)
- B. antillogorgium (J.E.Parkinson, Coffroth & LaJeunesse) J.E.Parkinson & LaJeunesse 2018 (früher Symbiodinium antillogorgium)
- B. dendrogyrum A.M Lewis, A.N.Chan & LaJeunesse 2018
- B. endomadracis (J.E.Parkinson, Coffroth & LaJeunesse) J.E.Parkinson & LaJeunesse 2018 (früher Symbiodinium endomadracis)
- B. faviinorum A.M.Lewis & LaJeunesse 2018
- B. meandrinium A.M.Lewis & LaJeunesse 2018
- B. minutum (LaJeunesse, J.E.Parkinson & J.D.Reimer) J.E.Parkinson & LaJeunesse 2018 - Typus (früher Symbiodinium minutum, Subtyp B1)[6]
- B. pseudominutum (J.E.Parkinson, Coffroth & LaJeunesse) J.E.Parkinson & LaJeunesse 2018 (früher Symbiodinium pseudominutum)
- B. psygmophilum (LaJeunesse, J.E.Parkinson & J.D.Reimer) J.E.Parkinson & LaJeunesse 2018 (früher Symbiodinium psygmophilum)
- Gattung: Cladocopium LaJeunesse & H.J.Jeong, 2018 (ehem. Symbiodinium Klade C)[13][14][15]
- Gattung: Durusdinium LaJeunesse, 2018 (ehem. Symbiodinium Klade D), mit Spezies:[18][19]
- D. boreum (LaJeunesse & C.A.Chen) LaJeunesse 2018 (früher Symbiodinium boreum, mit S. sp. 3 TCLJ-2013)[20]
- D. eurythalpos (LaJeunesse & C.A.Chen) LaJeunesse 2018 (früher Symbiodinium eurythalpos)
- D. glynii (D.C.Wham & LaJeunesse) LaJeunesse 2018 (früher Symbiodinium glynnii)[21][22]
- D. trenchii (LaJeunesse) LaJeunesse 2018 - Typus (früher Symbiodinium trenchii)
- E. voratum (H.J.Jeong, S.Y.Lee, N.S.Kang & LaJeunesse) LaJeunesse & H.J.Jeong 2018 - Typus (früher Symbiodinium voratum, Zooxanthella vorata; sowie Symbiodinium californium, Gymnodinium varians, Subtyp E1)[5]
- F. kawagutii LaJeunesse 2018 - Typus (früher Symbiodinium kawagutii)
- Gattung: Gerakladium LaJeunesse, 2018 (ehem. Symbiodinium Klade G), mit Spezies:[18][25]
- G. endoclionum (Ramsby & LaJeunesse) LaJeunesse 2018 - Typus (früher Symbiodinium endoclionum )
- G. spongiolum (M.S.Hill & LaJeunesse) LaJeunesse 2018 (früher Symbiodinium spongiolum)
- Es folgen weitere, nach 2018 durch Abspaltung entstandene neue Arten:
- Gattung: Freudenthalidium M.Nitschke, C.Brandão & C.Fidalgo, 2020[26]
- Freudenthalidium endolithicum M.Nitschke, C.Brandão & Frommlet 2020
- F. heronense M.Nitschke, C.Brandão & C.Fidalgo 2020 - Typus
- H. pauxillum Calado, Craveira & Frommlet 2020 - Typus
- Gattung: Miliolidium Pochon, LaJeunesse 2021[18] — abgetrennt von Durusdinium; Familie Symbiodiniaceae
- M. leei Pochon, LaJeunesse 2021
- „M. sp. D1.1“ Pochon et. al. 2007 – in Marginopora, Guam
- „M. sp. Psp1-05“ Carlos et. al. 1999 – freilebend, vergesellschaftet mit einem azooxanthellaten[Anm. 1] Schwamm aus Palau
- „M. sp.“ Reimer et. al. 2010 – Sediment, Ogasawara-Inseln
- Es folgen alte bzw. wiederhergestellte Gattungen:
- P. actiniarum Geddes 1882
- P. medusarum Geddes 1882 – Typus
- „P. sp. TCLJ-2021a“ LaJeunesse et al. 2021
- „P. sp. TCLJ-2021b“ LaJeunesse et al. 2021
- „P. sp. TCLJ-2021c“ LaJeunesse et al. 2021
- „P. sp. TCLJ-2021d“ LaJeunesse et al. 2021
- „P. sp. TCLJ-2021e“ LaJeunesse et al. 2021
- „P. sp. TCLJ-2021f“ LaJeunesse et al. 2021
- Gattung: Prosoaulax (F.Stein) Calado & Moestrup, 2005[30][31][32]
- P. lacustris (F.Stein) Calado & Moestrup, 2005 — Typus
- P. multiplex (J.Schiller) Calado & Moestrup, 2005
- P. viridis (J.Schiller) Calado & Moestrup, 2005
- Gattung: Zooxanthella Brandt, 1881
- Z. nutricula K.Brandt, 1881 (mit Synonymen Brandtodinium nutricula , Endodinium nutricula und Scrippsiella nutricula)[33]
- sonstige Kandidaten:
- ohne Gattungszuweisung:
- Symbiodiniaceae sp. TCLJ-2021a[35]
Anmerkungen zu Gattungen in der Familie neben Symbiodinium
[Bearbeiten | Quelltext bearbeiten]Miliolidium ist eine 2021 neu aufgestellte Gattung, die eng mit der Gattung Durusdinium (früher Symbiodinium Klade D) verwandt ist, aber mehrere von dieser genetisch und ökologisch abweichende Linien vereinigt. Ihre Mitgliedsspezies wurden an weit entfernten Orten gefunden wurden, was auf eine weite indopazifische Verbreitung hindeutet. Miliolidium leei wurde aus Foraminiferen der Gattung Amphisorus vom Golf von Eilat kultiviert. Seine peripheren Chloroplastenfortsätze sind in dieser Weise einzigartig blütenblatt- oder lappenförmig. Die Zellen besitzen ein Pyrenoid mit drei Stielen, die mit den Chloroplasten verbunden sind, es gibt keine Thylakoideinschlüsse. M. leei ist verwandt mit einem Isolat, das aus einem azooxanthellaten[Anm. 1] Schwamm aus Palau gezüchtet wurde, und einem anderen, das häufig von Foraminiferen der Gattung Marginopora vertebralis (Miliolida: Soritidae) in flachen Riffhabitaten aus Guam beherbergt wird.[18]
Freudenthalidium ist eine neue Gattung, nahe verwandt mit Gattung Fugacium (früher Symbiodinium Klade F).[18]
Halluxium ist eine weitere Gattung, nahe verwandt mit Gattung Cladicopium (früher Symbiodinium Klade C).[18]
Philozoon ist eine wiedererrichtete Gattung einer von Symbiodinium evolutionär abweichenden Linie, die bei symbiotischen Nesseltieren der gemäßigten Zonen verbreitet ist und in der Literatur mit verschiedenen informellen Namen bezeichnet wird, darunter „temperate-A“, „AI“, „Phylotype A“, „A-prime“ und „Mediterranean A“. Philozoon ist am engsten mit Symbiodinium (früher Klade A) verwandt, kommt aber im Gegensatz zu seinem tropischen Gegenstück in Wirten in flachen, gemäßigten marinen Habitaten der nördlichen und südlichen Hemisphäre vor, einschließlich des Mittelmeers, des nordöstlichen Atlantiks, des östlichen Australiens, Neuseelands und Chiles.[29] Diese Neusaufstellung ist derzeit (9. Juli 2021) noch nicht in AlgaeBase oder WoRMS eingepflegt.[36][37]
Mit der Neuaufstellung dieser Gattung wurden die folgenden beiden früheren Spezies abgeschafft:
- P. radiolariarum Geddes 1882
- P. siphonophorum Geddes 1882
Etymologie: griechisch „Philo“: „zu lieben wie ein Freund“, „zoon“ : „Tier“
Prosoaulax ist eine 2005 von der als polyphyletisch erkannten „Gattung“ Amphidinium s. l. abgespaltene Süßwasser-Gattung. Amphidinium ist eine Gattung nackter („athekater“) Dinoflagellaten, die durch ein kleines Epikon und ein größeres Hypokon gekennzeichnet ist,[30] sie gehören der Dinophyceen-Familie Gymnodiniaceae (Gymnodiniales) an.[38]
Nach WoRMS ist die
- Gattung: Symbiodinium Gert Hansen & Daugbjerg, 2009
ungültig;[39] akzeptierter Name mit einer einzigen Spezies ist stattdessen die Gattung Zooxanthella (in der Familie Symbiodiniaceae).
Man beachte, dass Zooxanthella microadriatica (Freudenthal) Loeblich III & Sherley, 1979 ungültig und Synonym für Symbiodinium microadriaticum Freudenthal, 1962 ist.
Die Verwendung der Abkürzung „Zoox“ (für Symbiodinium!) ist daher irreführend. Die Verwendung der informellen Beziehung „Zooxanthellen“ (en. "zooxanthellae") ist nicht nur auf die obige (monotypische) Gattung Zooxanthella beschränkt, sondern umfasst ganz allgemein nicht-taxonomisch alle endosymbiotisch lebenden Dinoflagellaten.
Externe Systematik
[Bearbeiten | Quelltext bearbeiten]Zu den näheren Verwandten der Symbiodiniaceae innerhalb der Dinophyceen gehört die Familie Suessiaceae mit der Gattung Polarella[40] mit der Spezies Polarella glacialis.[41] und der Kandidaten-Spezies „Polarella sp. CCMP1383“.[42]
Ausblick
[Bearbeiten | Quelltext bearbeiten]Die Analyse zusätzlicher phylogenetischer Marker für Vertreter der Symbiodiniaceae, die in Symbiose mir Nesseltieren, ausschließlich freilebend in unterschiedlichen, oft benthischen Lebensräumen vorkommen usw. ist noch lange nicht zu Ende und die Gesamtartenzahl der zugehörigen Arten kann möglicherweise nie genau bestimmt werden.[43][44][45][46][47][48][49][50]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ AlgaeBase: Suessiales Fensome & al., 1993
- ↑ a b NCBI: Suessiales Fensome et al. 1993 (order); graphisch: Suessiales, auf: Lifemap, NCBI version.
- ↑ a b AlgaeBase: Family Symbiodiniaceae Fensome & al., 1993
- ↑ a b WoRMS: Symbiodiniaceae Fensome, Taylor, Norris, Sarjeant, Wharton & Williams, 1993
- ↑ a b c d Todd C. LaJeunesse, John Everett Parkinson, Paul W. Gabrielson, Hae Jin Jeong, James Davis Reimer, Christian R. Voolstra, Scott R. Santos: Systematic revision of Symbiodiniaceae highlights the antiquity and diversity of coral endosymbionts. In: Current Biology. Band 28, Nr. 16, August 2018, S. 2570–2580, doi:10.1016/j.cub.2018.07.008, PMID 30100341 (unc.edu [PDF]). Insbes. Fig. 3
- ↑ a b c Kaz Kawamura, Satoko Sekida, Koki Nishitsuji, Eiichi Shoguchi, Kanako Hisata, Shigeki Fujiwara, Noriyuki Satoh: In vitro Symbiosis of Reef-Building Coral Cells With Photosynthetic Dinoflagellates, in: Front. Mar. Sci., 14. Juli 2021, doi:10.3389/fmars.2021.706308. Dazu:
- Nadja Podbregar: So fangen Korallen ihre Symbionten – Forscher beobachten erstmals die Aufnahme von Algen durch Korallenzellen, auf: scinexx.de vom 22. Juli 2021
- ↑ Robert K. Trench, Rudolf J. Blank: Symbiodinium Microadriaticum Freudenthal, S. Goreauii Sp. Nov., S. Kawagutii Sp. Nov. And S. Pilosum Sp. Nov.: Gymnodinioid Dinoflagellate Symbionts of Marine Invertebrates. In: Journal of Phycology. 23. Jahrgang, Nr. 3, 1987, S. 469–481, doi:10.1111/j.1529-8817.1987.tb02534.x.
- ↑ Rowena F. Stern, Ales Horak, Rose L. Andrew, Mary-Alice Coffroth, Robert A. Andersen, Frithjof C. Küpper, Ian Jameson, Mona Hoppenrath, Benoît Véron, Fumai Kasai, Jerry Brand, Erick R. James, Patrick J. Keeling: Environmental Barcoding Reveals Massive Dinoflagellate Diversity in Marine Environments. In: PLoS ONE. 5. Jahrgang, Nr. 11, 2010, S. e13991, doi:10.1371/journal.pone.0013991, PMID 21085582, PMC 2981561 (freier Volltext), bibcode:2010PLoSO...513991S.
- ↑ NCBI: Suessiaceae Fensome et al. 1993 (family); graphisch: Suessiaceae, auf: Lifemap, NCBI Version.
- ↑ WoRMS: Symbiodinium Freudenthal, 1962
- ↑ AlgaeBase: Breviolum J.E.Parkinson & LaJeunesse, 2018
- ↑ WoRMS: Breviolum J.E.Parkinson & LaJeunesse, 2018
- ↑ Daniel J. Thornhill, Allison M. Lewis, Drew C. Wham, Todd C. LaJeunesse: Host-Specialist Lineages Dominate The Adaptive Radiation of Reef Coral Endosymbionts, in: Evolution, Band 68, Nr. 2, S. 352–367, 13. September 2013, doi:10.1111/evo.12270
- ↑ AlgaeBase: Cladocopium LaJeunesse & H.J.Jeong, 2018
- ↑ WoRMS: Cladocopium LaJeunesse & H.J.Jeong, 2018
- ↑ Algal species helps corals survive in Earth's hottest reefs
- ↑ AlgaeBase: Cladocopium thermophyllum B.Hume, D'Angelo, E.G.Smith, J.R.Stevens, J.Burt & Wiedenmann, nom. inval. 2018
- ↑ a b c d e f g Xavier Pochon, Todd C. LaJeunesse: Miliolidium n. gen, a New Symbiodiniacean Genus Whose Members Associate with Soritid Foraminifera or Are Free-Living, in: Journal of Eukaryotic Microbiology, Band 68, Nr. 4, Mai 2021, doi:10.1111/jeu.12856. Insbes. Fig. 2
- ↑ AlgaeBase: Durusdinium LaJeunesse, 2018
- ↑ NCBI: Symbiodinium boreum (species)
- ↑ Drew C. Wham, Gang Ning, and Todd C. LaJeunesse: Symbiodinium glynnii sp. nov., a species of stress-tolerant symbiotic dinoflagellates from pocilloporid and montiporid corals in the Pacific Ocean, in: Phycologia, Band 56, Nr. 4, S. 396–409, doi:10.2216/16-86.1, Epub 21. März 2019
- ↑ AlgaeBase: Symbiodinium glynnii D.C.Wham & LaJeunesse 2017
- ↑ AlgaeBase: Effrenium LaJeunesse & H.J.Jeong
- ↑ AlgaeBase: Fugacium LaJeunesse, 2018
- ↑ AlgaeBase: Gerakladium LaJeunesse, 2018
- ↑ AlgaeBase: Freudenthalidium M.Nitschke, C.Brandão & C.Fidalgo, 2020
- ↑ AlgaeBase: Halluxium Calado, Craveiro &Frommlet, 2020
- ↑ NCBI: Philozoon (genus)
- ↑ a b Todd C. LaJeunesse, Joerg Wiedenmann, Pilar Casado-Amezúa, Isabella D’Ambra, Kira E. Turnham, Matthew R. Nitschke, Clinton A. Oakley, Stefano Goffredo, Carlos A. Spano, Victor M. Cubillos, Simon K. Davy, David J. Suggett: Revival of Philozoon Geddes for host-specialized dinoflagellates, ‘zooxanthellae’, in animals from coastal temperate zones of northern and southern hemispheres, in: European Journal of Phycology, Epub 28. Juni 2021, doi:10.1080/09670262.2021.1914863. Dazu:
- Jacinta Bowler: After 140 Years, Biologists Have 'Resurrected' The Genus of These Weird Yellow Cells, auf: sciencealert vom 5. Juli 2021
- Scientists resurrect 'forgotten' genus of algae living in marine animals, auf phys.org vom 1. Juli 2021
- ↑ a b Ant Nio, J. Calado, Øjvind Moestrup: On the freshwater dinoflagellates presently included in the genus Amphidinium, with a description of Prosoaulax gen. nov, in: Phycologia, Band 44, Nr. 1, Februar 2005, S. 112–119, [[doi:10.2216/0031-8884(2005)44[112:OTFDPI]2.0.CO;2]]
- ↑ AlgaeBase: Prosoaulax Calado & Moestrup, 2005
- ↑ WoRMS: Prosoaulax (F.Stein) Calado & Moestrup, 2005
- ↑ WoRMS: Zooxanthella nutricula K.Brandt, 1881
- ↑ NCBI: Symbiodinium sp. clade I und uncultured Symbiodinium sp. clade I (clade)
- ↑ NCBI: Symbiodiniaceae sp. TCLJ-2021a (species)
- ↑ AlgaeBase: Philozoon Geddes, 1882 Dinophyceae, keiner Familie zugewiesen, mit Spezies
- ↑ WoRMS: Philozoon Geddes Dinophyceae, keiner Familie zugewiesen
- ↑ NCBI: Amphidinium (genus)
- ↑ WoRMS: Symbiodinium Gert Hansen & Daugbjerg, 2009
- ↑ NCBI: Polarella (genus)
- ↑ A. Boere, B. Abbas, W. Rijpstra, G. Versteegh, J. Volkman, J. Sinninghe Damsté, M. Coolen: Late-Holocene succession of dinoflagellates in an Antarctic fjord using a multi-proxy approach: paleoenvironmental genomics, lipid biomarkers and palynomorphs. In: Geobiology. 7. Jahrgang, Nr. 3, 2009, S. 265–281, doi:10.1111/j.1472-4669.2009.00202.x, PMID 19515203.
- ↑ NCBI: Polarella sp. CCMP1383 (species)
- ↑ S. R. Santos, T. L. Shearer, A. R. Hannes, M. A. Coffroth: Fine-scale diversity and specificity in the most prevalent lineage of symbiotic dinoflagellates (Symbiodinium, Dinophyceae) of the Caribbean. In: Molecular Ecology. 13. Jahrgang, Nr. 2, 2004, S. 459–469, doi:10.1046/j.1365-294X.2003.02058.x, PMID 14717900 (semanticscholar.org).
- ↑ J. Christine Finney, Daniel Tye Pettay, Eugenia M. Sampayo, Mark E. Warner, Hazel A. Oxenford, Todd C. Lajeunesse: The Relative Significance of Host–Habitat, Depth, and Geography on the Ecology, Endemism, and Speciation of Coral Endosymbionts in the Genus Symbiodinium. In: Microbial Ecology. 60. Jahrgang, Nr. 1, 2010, S. 250–263, doi:10.1007/s00248-010-9681-y, PMID 20502891. JSTOR:40802290.
- ↑ Kevin De Queiroz: Species Concepts and Species Delimitation. In: Systematic Biology. 56. Jahrgang, Nr. 6, 2007, S. 879–886, doi:10.1080/10635150701701083, PMID 18027281.
- ↑ E. M. Sampayo, S. Dove, Todd C. Lajeunesse: Cohesive molecular genetic data delineate species diversity in the dinoflagellate genus Symbiodinium. In: Molecular Ecology. 18. Jahrgang, Nr. 3, 2009, S. 500–519, doi:10.1111/j.1365-294X.2008.04037.x, PMID 19161470.
- ↑ Todd C. Lajeunesse, Daniel J. Thornhill: Improved Resolution of Reef-Coral Endosymbiont (Symbiodinium) Species Diversity, Ecology, and Evolution through psbA Non-Coding Region Genotyping. In: PLoS ONE. 6. Jahrgang, Nr. 12, 2011, S. e29013, doi:10.1371/journal.pone.0029013, PMID 22216157, PMC 3247227 (freier Volltext), bibcode:2011PLoSO...629013L.
- ↑ Daniel J. Thornhill, Todd C. Lajeunesse, Scott R. Santos: Measuring rDNA diversity in eukaryotic microbial systems: How intragenomic variation, pseudogenes, and PCR artifacts confound biodiversity estimates. In: Molecular Ecology. 16. Jahrgang, Nr. 24, 2007, S. 5326–5340, doi:10.1111/j.1365-294X.2007.03576.x, PMID 17995924.
- ↑ X. Pochon, L. Garcia-Cuetos, A. C. Baker, E. Castella, J. Pawlowski: One-year survey of a single Micronesian reef reveals extraordinarily rich diversity of Symbiodinium types in soritid foraminifera. In: Coral Reefs. 26. Jahrgang, Nr. 4, 2007, S. 867–882, doi:10.1007/s00338-007-0279-x, bibcode:2007CorRe..26..867P (rero.ch [PDF]).
- ↑ James Davis Reimer, Md Mahfuzur Rahman Shah, Frederic Sinniger, Kensuke Yanagi, Shoichiro Suda: Preliminary analyses of cultured Symbiodinium isolated from sand in the oceanic Ogasawara Islands, Japan. In: Marine Biodiversity. 40. Jahrgang, Nr. 4, 2010, S. 237–247, doi:10.1007/s12526-010-0044-1.
![Zellen der Koralle Acropora tenuis in vitro 7 Tage nach Zusammenfügen mit Breviolum minutum. Eine (schwarze Pfeilspitze), zwei (graue Pf.) und drei Algen (weiße Pf.) in einzelnen Korallenzellen.[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/50/Fmars-08-706308-g006C3.jpg/180px-Fmars-08-706308-g006C3.jpg)
![Ebensolche Korallenzelle mit Algenzelle darin, daneben Vakuole (Pfeilspitze); Scheinfüßchen (Pfeil oben); 2 freie Algenzellen.[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2d/Fmars-08-706308-g001D.jpg/180px-Fmars-08-706308-g001D.jpg)