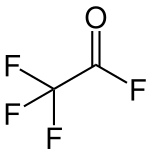
Trifluoracetylfluorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trifluoracetylfluorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2OF4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
Hydrolyse in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Trifluoracetylfluorid (auch Trifluoressigsäurefluorid) ist eine organisch chemische Verbindung aus der Gruppe der Carbonsäurefluoride, konkret das Fluorid der Trifluoressigsäure.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Trifluoracetylfluorid kommt in der Atmosphäre als Abbauprodukt von fluorierten Verbindungen vor, die als Kältemittel eingesetzt werden, beispielsweise 1,1,1,2-Tetrafluorethan, 2-Chlor-1,1,1-trifluorethan, 2,3,3,3-Tetrafluorpropen oder 1,1,1,2,3,3,3-Heptafluorpropan. Durch Photolyse kann es weiter zu Tetrafluormethan und Kohlenmonoxid zersetzt werden.[4] Durch Hydrolyse entsteht aus Trifluoracetylfluorid Trifluoressigsäure.[5]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Trifluoracetylfluorid kann durch die elektrochemische Fluorierung von Acetylchlorid oder Acetanhydrid hergestellt werden.[6] Es entsteht auch durch Umlagerung von Perfluorethylacetat, die zwei Moleküle Trifluoracetylfluorid ergibt.[7]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Trifluoracetylfluorid ist ein wichtiges industrielles Intermediat für Trifluoressigsäure, die durch dessen Hydrolyse hergestellt wird.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d SynQuest Labs: Trifluoroacetyl fluoride, 95%, abgerufen am 1. Mai 2024.
- ↑ E.L Pace, P.E Hodge: Thermodynamic properties of trifluoroacetyl fluoride from 14 K to its boiling temperature. In: The Journal of Chemical Thermodynamics. Band 4, Nr. 3, 1972, S. 441–447, doi:10.1016/0021-9614(72)90027-4.
- ↑ Xinli Song: Catalytic hydrolyses of trifluoroacetyl fluoride by water. In: Chemical Physics Letters. Band 713, 2018, S. 137–144, doi:10.1016/j.cplett.2018.10.038.
- ↑ Aaron M. Jubb, Max R. McGillen, Robert W. Portmann, John S. Daniel, James B. Burkholder: An atmospheric photochemical source of the persistent greenhouse gas CF4. In: Geophysical Research Letters. Band 42, Nr. 21, 16. November 2015, S. 9505–9511, doi:10.1002/2015GL066193.
- ↑ Ziyuan Wang, Yuhang Wang, Jianfeng Li, Stephan Henne, Boya Zhang, Jianxin Hu, Jianbo Zhang: Impacts of the Degradation of 2,3,3,3-Tetrafluoropropene into Trifluoroacetic Acid from Its Application in Automobile Air Conditioners in China, the United States, and Europe. In: Environmental Science & Technology. Band 52, Nr. 5, 2018, S. 2819–2826, doi:10.1021/acs.est.7b05960.
- ↑ Simón E. López, José Salazar: Trifluoroacetic acid: Uses and recent applications in organic synthesis. In: Journal of Fluorine Chemistry. Band 156, Dezember 2013, S. 73–100, doi:10.1016/j.jfluchem.2013.09.004.
- ↑ J. L. Adcock, R. J. Lagow: Synthesis of perfluoro-1,4-dioxane, perfluoro(ethyl acetate), and perfluoropivaloyl fluoride by direct fluorination. In: Journal of the American Chemical Society. Band 96, Nr. 24, November 1974, S. 7588–7589, doi:10.1021/ja00831a053.
- ↑ Simón E. López, José Salazar: Trifluoroacetic acid: Uses and recent applications in organic synthesis. In: Journal of Fluorine Chemistry. Band 156, Dezember 2013, S. 73–100, doi:10.1016/j.jfluchem.2013.09.004.



